Edição de genes
CRISPR-Cas
Edição XXII | 01 - Jan . 2018 A
trajetória dos avanços científicos pode ser vista como descobertas contínuas,
achados e invenções que, de forma permanente, aumentam e acumulam o
conhecimento que se aplica a produtos e processos com impacto em nossas vidas.
No entanto, esta visão do progresso científico cumulativo não é unânime e,
fundamentalmente, a escola de Thomas Kuhn argumenta que as mudanças científicas
se dão através de revoluções e ocorrem quando um antigo paradigma é substituído
total ou parcialmente por outro.
Em qual dos dois
contextos podemos localizar o que está acontecendo no campo da genética e da
criação de cultivares? O que observamos é que, após um começo baseado no
empirismo e na seleção dos melhores indivíduos, essas atividades foram
transformadas em disciplinas científicas nos limites do conhecimento humano. A
domesticação, a seleção dos melhores espécimes, o cruzamento entre indivíduos,
a introgressão de genes de outras espécies, a melhoria de linhas puras,
híbridos, mutagênese induzida (aleatória), marcadores moleculares e transgênese
tornaram-se parte do vocabulário que permitiu aumentar o rendimento das
culturas, torná-las mais resistentes a insetos/doenças e melhorar suas
qualidades industriais.
Nada nesta área do conhecimento permanece
estável por muito tempo. Decifrar o genoma humano em 2003 exigiu 13 anos de
trabalho, a maior colaboração científica e mais de três bilhões de dólares de
fundos de investimento público. Este mesmo trabalho, hoje, pode ser feito em um
dia a um custo inferior a US$ 1.000. Mas, o que marca essa mudança abrupta é
que existe atualmente um bom conhecimento da informação de sequências e
funcionamento dos genomas dos organismos como nunca antes tinha acontecido.
Neste contexto, a tecnologia CRISPR-Cas (Clustered
Regularly Interspaced Short Palindromic Repeats – CRISPR Associated Genes Cas)
abriu uma avenida de possibilidades de tal magnitude que não é mais uma questão
de imaginar quais alimentos novos poderíamos ter, mas da extensão que ele terá
em nossas vidas, dado que seu escopo se estende ao tratamento de distúrbios
genéticos em seres humanos, saúde animal e setor de bioindústria.

Plantas de mandioca in vitro (Manihot esculenta). O do lado esquerdo foi desenvolvido por CRISPR-Cas9 para silenciar o gene da enzima fitoeno dessaturase, o que significa que as folhas não conseguem sintetizar a clorofila e, portanto, descolorir. A planta à direita é de tipo selvagem.
Durante o 6º Congresso da Associação das Sementes das Américas (SAA), realizado em Cartagena de Indias, Colômbia, em setembro de 2017, a edição de Gene e, em particular, a tecnologia CRISPR-Cas foi o principal foco de debate e discussão em termos de aspectos técnicos, bem como seu escopo, uso, regulamentação e propriedade intelectual dos novos produtos obtidos.
CRISPR-Cas
O sistema CRISPR-Cas foi descoberto e descrito em bactérias pelo cientista espanhol Francisco Mojica (Universidade de Alicante, Espanha) e funciona nesses organismos como um mecanismo imunodefensivo herdável. Após esta descoberta, uma série de investigações, envolvendo o argentino Luciano Marrafini (Universidade Rockefeller), a francesa Emmanuelle Charpentier (Instituto Max Planck), a americana Jennifer Doudna (Universidade da Califórnia, Berkeley) e o americano de origem chinesa Feng Zhang (Instituto largo, EUA), permitiu transformar o sistema em uma ferramenta precisa de edição de genes, capaz de ser aplicado em qualquer tipo de organismo.
O grande sucesso da tecnologia baseia-se na sua simplicidade, velocidade, precisão, repetibilidade e baixo custo, em comparação com tudo o que é conhecido até agora. A edição de genes, de uma ideia, passou a ser uma ferramenta concreta disponível para laboratórios de biologia molecular de média complexidade.
O poder da tecnologia baseia-se na sua capacidade de direcionar a proteína Cas (que corta a cadeia de DNA em um ou ambos os filamentos) para o local de corte preciso usando um RNA guia derivado do CRISPR e contendo uma sequência de aproximadamente 20 nucleotídeos que se encaixa com a sequência alvo do DNA do organismo receptor.
O DNA cortado no lugar preciso é recomposto pelo sistema natural de reparo celular e isso pode causar inserções ou deleções de bases que podem alterar a função dos genes. Os sistemas CRISPR-Cas mais desenvolvidos não deixam as mudanças ao acaso e trabalham com modelos de DNA que estabelecem exatamente o que a substituição da base deve ser. Esta substituição pode ser uma ou várias bases, ou mesmo genes inteiros. Além disso, não é necessário fazer uma alteração de cada vez, o genoma pode ser editado em vários lugares simultaneamente.
Acesso à tecnologia CRISPR-Cas
Apesar do seu potencial, há questões sobre o acesso à tecnologia devido a um conflito relacionado à sua propriedade. O CRISPR e o Cas não podem ser patenteados, uma vez que são componentes preexistentes na natureza. O que pode ser patenteado é o seu processo para aplicar tecnologia em organismos onde esses componentes não existem, bem como todo o desenvolvimento de RNA-Guias.
A Universidade da Califórnia em Bekeley, do Instituto Broad (sob o MIT e a Universidade de Harvard), principalmente, e da Universidade Rockefeller, em menor grau, entraram em uma disputa sobre patentes que se originou nos Estados Unidos, e agora tem extensões para a União Europeia e Ásia. Na única decisão conhecida, o Tribunal dos Estados Unidos decidiu a favor do Broad Institute e à patente concedida a Feng Zhang, mas houve apelação. É difícil prever o desenvolvimento desses eventos, pois eles também podem ter soluções diferentes em diferentes continentes.
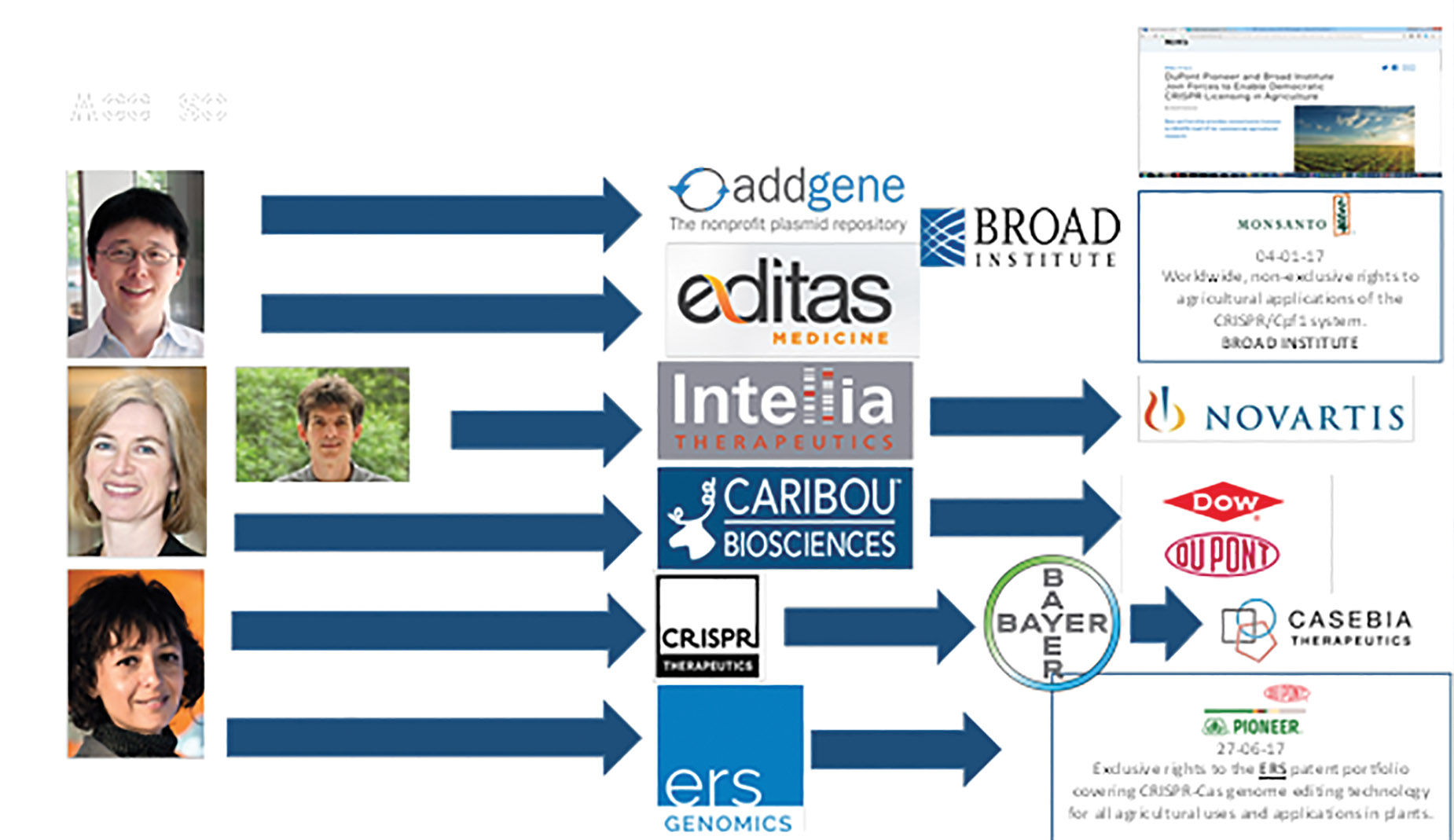
Embora essas disputas e seus efeitos secundários continuem seu curso, os principais atores criaram empresas através das quais estão licenciando seus processos. A seguir, é apresentado um resumo:
• Feng Zhang criou a Editas Medicine, onde, por sua vez, colocou seus processos na Addgene, que é um repositório de plasmídeos ao qual todos os pesquisadores têm acesso. Suas licenças, por sua vez, também são canalizadas pelo Instituto Broad.
• Jennifer Doudna e Luciano Marrafini criaram a Intellia Therapeutics.
• Jennifer Doudna com outro grupo de pesquisadores, criou a Caribou Biosciences.
• Emmanuelle Charpentier criou a CRISR Therapeutics e, juntamente com a empresa Bayer, criou a Casebia Therapeutics. O mesmo cientista fundou a ERS Genomics.
• Todas as empresas mais importantes assinaram licenças não exclusivas com essas empresas.
A solução da controvérsia sobre patentes está imersa em um problema de magnitude com poucos precedentes. Até o início deste ano, foram detectadas mais de mil pedidos de patentes relacionadas ao CRISPR-Cas, sendo 62% pertencentes a instituições acadêmicas. Tudo isso é outra mudança não menos importante do novo paradigma. A academia, mais uma vez, desempenhou um papel de liderança na história, mas agora os acadêmicos também são estrelas centrais nos aspectos de comercialização de suas tecnologias.

BIOHEURIS equipe de pesquisa
Proteção intelectual e regulamentação dos produtos CRISPR-Cas
Ambos os aspectos são extremamente importantes e envolvem algumas
questões difíceis de responder: como é que uma edição de genes é protegida? Os
produtos editados são geneticamente modificados?
A primeira dessas questões relacionadas à
propriedade intelectual levanta o fato de que, na maioria das legislações, os
produtos preexistentes na natureza não constituem assunto patenteável.
Quando se trata de transgênese, as respostas são relativamente fáceis. Por
exemplo, uma construção genética desenvolvida em um laboratório e não
preexistente na natureza é considerada sujeita patenteável desde que todos os
outros pressupostos de patenteabilidade sejam atendidos. Mas o que acontece se
você editar um gene preexistente na natureza? O gene editado é patenteável? A
discussão é relevante, uma vez que a resposta potencial de que os Direitos
dos Obtentores seria a solução, também não é completamente satisfatória. Se um
gene é editado para produzir um fenótipo existente, a doutrina derivada dos
Atos da UPOV não é suficiente, uma vez que a variedade vegetal é definida pela
expressão dos caracteres de um genótipo. Duas variedades de expressão idêntica,
para a UPOV, são idênticas.
Quanto à segunda pergunta, as
dificuldades não são menores. Os produtos editados são organismos geneticamente
modificados? De acordo com a definição do Protocolo de Cartagena, um organismo
geneticamente modificado é aquele que contém uma nova combinação de material
genético. No momento, Argentina, Chile, Israel e alguns outros países que estão
no estágio final de desenvolvimento estão adotando o critério de que uma “nova
combinação de material genético” é a inserção no genoma de forma estável e
conjunta de um ou mais genes ou sequências de DNA, que fazem parte de uma construção genética
definida. Claramente, e de acordo com este critério, a edição de um gene para
modificar sequências de bases, como ocorre na natureza e sem a inserção de um
ou mais genes, não é um organismo geneticamente modificado e, portanto, um
produto editado através de CRISPR-Cas de tais características é idêntico a um
organismo convencional.

Plântulas de variedade melhorada de repolho
As implicações deste critério são transcendentes,
tanto por seus aspectos positivos como negativos. Quanto ao primeiro, muitos
dos produtos derivados do CRISPR-Cas não teriam que passar pelo sistema
regulatório, pois são convencionais e não apresentam riscos diferentes dos
produtos que resultam de todas as técnicas conhecidas de melhoramento vegetal.
Se este critério for aceito, os custos regulatórios cairão de forma
significativa, reduzindo o tempo de chegada ao mercado. No entanto, também
podem ocorrer efeitos negativos se os diferentes países adotarem
diferentes critérios de exclusão, correndo o risco de uma implementação global
de um sistema de decisão assimétrico com consequências comerciais
imprevisíveis.
Certamente,
a tecnologia CRISPR-Cas tem todo o potencial para resultados transcendentes na
criação de cultivares. Entretanto, ao mesmo tempo, esse notável avanço
introduziu uma série de questões sobre acesso à tecnologia e proteção e
regulação de produtos derivados. Será necessária uma discussão urgente e
inteligente para permitir que eles atinjam seus destinatários finais.
"A solução da controvérsia sobre patentes está imersa em um problema de magnitude com poucos precedentes. Até o início deste ano, foram detectadas mais de mil pedidos de patentes relacionadas ao CRISPR-Cas, sendo 62% pertencentes a instituições acadêmicas"
Exemplos de Desenvolvimento
Regional:
ARGENTINA: a
empresa BIOHEURIS é uma “StartUp” de cientistas e empresários argentinos com
sede na cidade de Rosario. O trabalho que estão realizando em soja tem como
objetivo editar proteínas a partir de três modos de ação de herbicidas
independentes, usando CRISPR-Cas, de modo a facilitar o uso de herbicidas
múltiplos. Isso permitiria diminuir as doses de cada uma delas e atrasar o
aparecimento de plantas daninhas resistentes. Para isso, eles associaram um
pacote tecnológico em que os herbicidas são fornecidos pela empresa ROTAM,
e o germoplasma de soja pela empresa SANTA ROSA SEMILLAS.
Para
determinar se os produtos em desenvolvimento seriam considerados “OGM”, a
Bioheuris fez uma Consulta Prévia para a Direção de Biotecnologia do Ministério
da Agricultura. Após avaliar as informações apresentadas, as autoridades
reguladoras consideraram que o produto em desenvolvimento não é considerado um
OGM. A classificação desta tecnologia como “não-OGM” facilita seu acesso ao
mercado, diminuindo o custo de desenvolvimento e o tempo de entrada no mercado.
COLÔMBIA: O Centro Internacional de Agricultura Tropical (CIAT) na Colômbia, está usando a tecnologia CRISPR-Cas como ferramenta de edição para a melhoria das culturas do arroz, mandioca e feijão, buscando melhorar os atributos agronômicos e/ou validar genes candidatos. Em arroz, o foco está nos genes de resistência ao vírus da folha branca (HBRV), bem como nos genes de erosão, resistência a Xanthomonas e eliminação de marcadores de seleção em linhas transgênicas ricas em ferro. Na mandioca, o CIAT trabalha para obter variedades cerosas, resistência a herbicidas e geração de haploides. Por outro lado, em feijão, estão se dedicando à qualidade nutricional, eliminando compostos antinutricionais. Também estenderam o uso da ferramenta para detectar patógenos, com base no sistema SHERLOCK desenvolvido pelo Broad Institute (MIT) e Harvard.